BỆNH SỐT RÉT – HUMAN MALARIA
BỆNH SỐT RÉT – HUMAN MALARIA
I. Mô tả chung
Bệnh sốt rét là một căn bệnh truyền nhiễm do virus Plasmodium ở người gây nên. Bệnh lây theo đường máu chủ yếu la do vật trung gian là loài muỗi Anopheles truyền. Có 5 loại ký sinh trùng gây bệnh sốt rét cho người Plasmodium falciparum; Plasmodium vivax, Plasmodium malariae; Plasmodium ovale và Plasmodium knowlesi. Bệnh thường biểu hiện bằng những cơn sốt rét điển hình với 3 triệu chứng: rét run, sốt và vã mồ hôi. Bệnh tiến triển có chu kỳ và có hạn định nếu không bị tái nhiễm. Ký sinh trùng sốt rét gây miễn dịch đặc hiệu nhưng không bền vững.
Bệnh lưu hành địa phương, trong những điều kiên thuận lợi có thể tiến triển bùng phát thành dịch, hiên nay vẫn chưa có vaccine phòng bệnh, có thuốc điều trị đặc hiệu và có thể phòng chống được. Ở nước ta bệnh thường lưu hành ở vùng rừng, đồi, núi ven biển nước lợ; bệnh xảy ra quanh năm nhưng chủ yếu là vào những tháng mùa mưa
Trường hợp xác định mắc sốt rét là trường hợp có ký sinh trùng sốt rét trong máu được xác định bằng xét nghiệm lam máu nhuộm giêm sa, xét nghiệm chẩn đoán nhanh phát hiện kháng nguyên hoặc xét nghiệm bằng ký thuật sinh học phân tử.

II. Các yêu cầu về việc thực hiện xét nghiệm
1/ Bảo đảm chất lượng xét nghiệm
A/ Trước xét nghiệm
Đảm bảo chất lượng mẫu đầu vào
- Loại mẫu: máu toàn phần đựng trong ống chống đông, mẫu máu khô trên giấy thấm, lam máu nhuộm giemsa
- Bảo quản mẫu: Mẫu máu toàn phần, máu được bảo quản trong chất chống đông phải được bảo quản ở điều kiện 2-8oC chuyển về phòng xét nghiệm và thực hiện xét nghiệm trong vòng 3 ngày; bảo quản ở nhiệt độ -20oC đến -70oC tối đa 01 năm. Mẫu máu khô trên giấy thấm và lam máu được bảo quản ở nhiệt độ môi trường, chống mốc, chống tác động của côn trùng gây hại.
- Kiểm tra chất lượng mẫu: mẫu không bị đổ vỡ, đúng loại mẫu cho yêu cầu xét nghiệm, mẫu đảm bảo nhiệt độ khi vận chuyển, chất lượng tốt, đủ thể tích mẫu cho xét nghiệm.
B. Trong xét nghiệm:
a) Nội kiểm:
Thực hiện nội kiểm định kỳ trong: sử dụng các chứng chuẩn (chứng âm, chứng dương, chứng nội kiểm), bộ lam mẫu trong mỗi lần tiến hành xét nghiệm.
Kết quả của các lần xét nghiệm chỉ được công nhận khi
- Chứng dương cho kết quả dương tính
- Chứng âm cho kết quả âm tính
- Chứng nội kiểm cho kết quả đúng yêu cầu của bộ sinh phẩm
b) Đánh giá từ bên ngoài: Tham gia đánh giá từ bên ngoài (ngoại kiểm, liên phòng hoặc phòng xét nghiệm tham chiếu) và thực hiện hành động khắc phục nếu không đạt.
c) Sau xét nghiệm:
Bảo quản và lưu trữ mẫu bệnh phẩm
- Lưu trữ mẫu vật được xác định theo quy trình chuẩn
- Tùy thuộc loại mẫu xét nghiệm mà phương thức xử lý và bảo quản mẫu khác nhau
III. Phương pháp xét nghiệm:
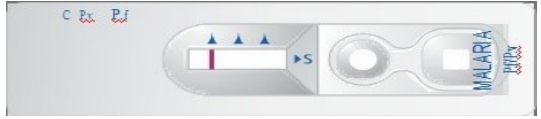
1/ Kỹ thuật xét nghiệm chẩn đoán nhanh phát hiện sốt rét.
a) Phạm vi áp dụng:
Phương pháp này áp dụng cho xét nghiệm ký sinh trùng sốt rét trong mẫu máu mao mạch, thu thập từ đầu ngón tay; hoặc máu tĩnh mạch bằng cách nhận diện kháng nguyên của ký sinh trùng sốt rét qua phản ứng miễn dịch kháng nguyên kháng thể
b) Nguyên lý:
Kháng thể đặc trưng của người với từng loại ký sinh trùng sốt rét được gắn lên các que thử có khả năng kết hợp đặc hiệu với kháng nguyên – protein của ký sinh trùng sốt rét.
Nếu trong mẫu máu xét nghiệm có các loại ký sinh trùng đặc hiêu thì kháng nguyên kết hợp với kháng thể tạo ra các vạch dương tính có màu.
c) Thực hiện xét nghiệm:
- Mẫu bệnh phẩm
+ Máu đầu ngón tay: lau bỏ giọt máu đầu, máu tĩnh mạch bảo quản trong chất chống đông.
+ Thể tích: 5μl
- Tiến hành xét nghiệm:
+ Lấy 5μl nhỏ vào giếng mẫu hình tròn – có ký hiệu chữ S
+ Nhỏ 4 giọt dung môi vào giếng hình vuông
+ Chờ 15-30 phút để đọc kết quả; không đọc kết quả khi quá 30 phút
d) Đọc và nhận định kết quả
- Không xuất hiện vạch C: không ghi nhận kết quả này và thực hiện lại trên quả test khác. Chỉ đọc và kết luận kết quả khi có sự xuất hiện của vạch chứng C
- Mẫu âm tính: chỉ xuất hiện vạch ở vị trí C

2/ Phương pháp xét nghiệm 2 loại ký sinh trùng sốt rét gây bệnh cho người trên mẫu máu bằng kỹ thuật realtime PCR
a) Phạm vi áp dụng:
Phương pháp này áp dụng cho việc xét nghiệm ký sinh trùng sốt rét trong mẫu máu mao mạch thu thập từ đầu ngón tay hoặc máu tĩnh mạch bằng cách nhận diện gen đặc trưng của ký sinh trùng sốt rét qua phản ứng realtime PCR
b) Thực hiện xét nghiệm:
- Mẫu bệnh phẩm: máu toàn phần
– Tách chiết DNA theo hướng dẫn của bộ TopPURE® BLOOD DNA EXTRACTION KIT (HI-132) của công ty ABT
Các bước tiến hành tách chiết
- Hút 400 μL BL Buffer cho vào tube 1.5mL.
- Chuyển 200 μL máu toàn phần cho vào tube 1.5 mL chứa sẵn BL Buffer nếu lượng thể tích nhỏ hơn 200μL thì thêm một lượng PBS Buffer đến khi đủ 200 μL. Thêm 20 μL Proteinase K, vortex đều và ủ 72oCtrong 10 phút.
(Chú ý: Đối với trường hợp sử dụng chứng nội (IC) để kiểm soát quá trình tách chiết thì IC được cho vàocùng với mẫu ở bước này.)
- Thêm 200 μL Ethanol (96-100%), trộn đều và chuyển hỗn hợp sang cột silica đặt sẵn trong tube 2 mL. Ly tâm ở tốc độ 13,000 rpm trong 1 phút. Giữ lại cột và loại bỏ phần chất lỏng bên dưới.
- Đặt lại cột vào tube 2 mL cũ. Thêm 500 μL WB1 buffer và ly tâm ở tốc độ 13,000 rpm trong 1 phút. Giữ lại cột và loại bỏ phần chất lỏng bên dưới.
- Đặt lại cột vào tube 2 mL cũ. Thêm 500 μL WB2 buffer và ly tâm ở tốc độ 13,000 rpm trong 1 phút. Giữ lại cột và loại bỏ phần chất lỏng bên dưới. Lặp lại bước này 1 lần nữa.
- Đặt lại cột vào tube 2 mL cũ. Làm khô cột bằng cách ly tâm ở tốc độ 13,000 rpm trong 1 phút.
- Chuyển cột sang tube 1.5 mL mới. Thêm 50 μL EB buffer và ủ một phút ở nhiệt độ phòng. Ly tâm ở tốc độ 13,000 rpm trong 1 phút, thu phần dịch chứa DNA bên dưới.
- DNA được sử dụng ngay hoặc bảo quản ở -20oC
– Tiến hành chạy Realtime PCR thực hiện theo hướng dẫn của bộ TopSENSI® Plasmodium falciparum/vivax qPCR KIT (SQH-112)
- Rã đông ống fal/vi qPCR mix, trộn đều, sau đó spindown để toàn bộ chất lỏng di chuyển xuống đáy. Chuẩn bị mỗi phản ứng bằng cách chia 15 μL từ ống fal/vi qPCR mix vào mỗi tube PCR (mỗi ống chia được 24-25 test).
- Hút 10 μL dịch DNA mẫu, chứng âm PCR, chứng âm tách chiết, chứng dương cho vào các tube fal/vi qPCR mix đã chuẩn bị ở trên. Chú ý: – Mỗi lần chạy nên có ít nhất 1 chứng âm tách chiết, 1 chứng dương và 1 chứng âm PCR. – Chuẩn bị phản ứng theo thứ tự sau: Chứng âm PCR, chứng âm tách chiết, mẫu và chứng dương.
- Đóng nắp tube PCR và spindown để chất lỏng di chuyển xuống đáy trước khi đặt vào máy.
- Chọn kênh màu FAM cho P. falciparum, TEXAS RED cho P. vivax và kênh màu HEX cho chứng nội (IC).
- Cài đặt chương trình nhiệt như bên dưới:
1 chu kỳ: 95°C 3 phút
45 chu kỳ: 95°C 10 giây
58°C 40 giây (chọn đọc tín hiệu ở bước này)
c) Phân tích kết quả
- Mẫu âm tính với cả P. falciparum và P. vivax: chỉ có đường biểu diễn huỳnh quang HEX của chứng nội vượt lên khỏi ngưỡng tín hiệu
- Không xuất hiện tín hiệu nào, kể cả màu HEX: Phản ứng qPCR bị ức chế, do đó không thể kết luận được là mẫu âm tính hay dương tính. Tiến hành pha loãng mẫu 10 lần hoặc tách lại DNA.
- Mẫu dương tính với P. falciparum: đường biểu diễn huỳnh quang FAM, HEX cùng vượt lên khỏi ngưỡng tín hiệu. Trong 1 số trường hợp mẫu dương tính mạnh với trình tự mục tiêu, đường biểu diễn huỳnh quang HEX có thể nằm dưới ngưỡng tín hiệu.
- Mẫu dương tính với P. vivax: đường biểu diễn huỳnh quang Texas Red, HEX cùng vượt lên khỏi ngưỡng tín hiệu. Trong 1 số trường hợp mẫu dương tính mạnh với trình tự mục tiêu, đường biểu diễn huỳnh quang HEX có thể nằm dưới ngưỡng tín hiệu.
Tài liệu tham khảo:
” Sổ tay xét nghiệm bệnh truyền nhiễm tâp 1″ – Bộ y tế
” TopPURE® BLOOD DNA EXTRACTION KIT (HI-132)”
” TopSENSI® Plasmodium falciparum/vivax qPCR KIT (SQH-112)”






