BỆNH RUBELLA
BỆNH RUBELLA
I. Mô tả chung

Bệnh Rubella là một bệnh truyền nhiễm, do vi rút Rubella gây nên. Vi rút Rubella thuộc giống Rubivirus của họ Togaviridae. Bệnh lưu hành trên toàn thế giới, thường xuất hiện vào mùa đông xuân, có thể xảy ra thành dịch.
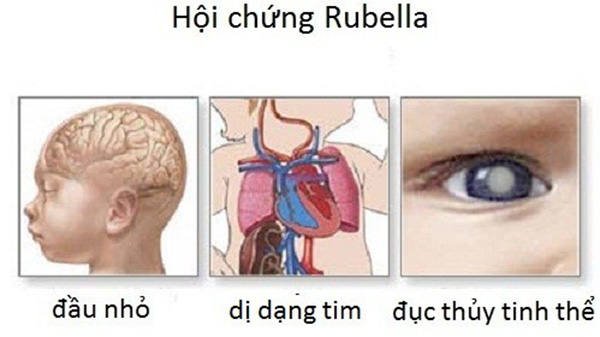
Tuy bệnh Rubella là một bệnh lây nhiễm không nguy cấp (không gây nên biến chứng nguy hiểm, không gây chết người) như bệnh sởi (thường gây những biến chứng trầm trọng: viêm phổi, viêm phế quản, viêm não, viêm cơ tim, viêm tai giữa, rối loạn tiêu hóa…) nhưng lại khá nghiêm trọng do có khả năng gây nên những dị tật bẩm sinh nặng nề ở bào thai.
Thai phụ mắc bệnh Rubella trong 3 tháng đầu của thai kỳ sẽ dễ bị những tai biến như sẩy thai, thai chết trong tử cung hoặc gây nên những dị dạng cho thai nhi sau khi sinh như: các khuyết tật về tim, đục thủy tinh thể, điếc bẩm sinh, chậm phát triển trí tuệ…
Bệnh Rubella lây truyền qua đường hô hấp khi người lành: (1) Hít phải những giọt dịch tiết đường mũi họng (nước bọt, nước mũi) có chứa vi rút của người bệnh khi tiếp xúc trực tiếp mặt đối mặt với người bệnh; (2) Tiếp xúc với các vật dụng, các bề mặt (sàn nhà, bàn ghế, đồ chơi…) có dính chất tiết mũi họng của người bệnh. Người bị bệnh Rubella có thể lây truyền bệnh cho người khác một tuần trước khi phát ban và từ 1 đến 2 tuần sau khi ban đã lặn hết.
II. Yêu cầu chung.
1/ Đảm bảo chất lượng xét nghiệm
A/ Trước xét nghiệm
Đảm bảo chất lượng mẫu đầu vào
– Mẫu máu từ 2 -3 ml trong tuýp không chứa chất chống đông: lấy tốt nhất từ 4 – 28 ngày sau phát ban, ly tâm lấy huyết thanh (không hoặc ít tan máu), bảo quản tại tủ lạnh 2oC – 8oC (tối đa 72 giờ) hoặc tủ lạnh – 20oC.
– Dịch ngoáy họng: lấy sớm trong vòng 5 ngày sau phát ban khi có viêm long đường hô hấp, cho tăm bông ngoáy họng trong môi trường (3 ml) bảo quản vi rút. Dịch ngoáy họng phải bảo quản tại tủ lạnh 2oC – 8oC (tối đa 72 giờ) hoặc tủ âm sâu (từ -70oC trở xuống).
– Trong quá trình vận chuyển giữ tại 2°C – 8°C, – 20°C, hoặc -70°C theo nhiệt độ bảo quản tương ứng.
– Kiểm tra chất lượng mẫu: mẫu không bị đổ vỡ, đúng loại mẫu cho yêu cầu xét nghiệm, mẫu đảm bảo nhiệt độ khi vận chuyển, chất lượng tốt, đủ thể tích mẫu cho xét nghiệm.
– Kiểm tra thông tin trên tuýp mẫu có trùng khớp với thông tin bệnhnhân trong phiếu gửi mẫu hay phiếu yêu cầu xét nghiệm
B/ Trong xét nghiệm
a) Nội kiểm:
– Đối với xét nghiệm ELISA, ngoài các mẫu chứng theo sinh phẩmcần sử dụng mẫu nội kiểm độc lập.
– Đối với kỹ thuật RT-PCR luôn sử dụng mẫu chứng trong mỗi lần xét nghiệm, trong đó:
- Chứng âm:
+ Chứng âm phản ứng (NTC): phải cho kết quả âm tính đối với phương pháp RT-PCR.
+ Chứng âm tách chiết (NEC): mẫu tách chiết là môi trường vận chuyển và được tách chiết cùng mẫu bệnh phẩm: phải cho kết quả âm tính đối với phương pháp RT-PCR.
- Chứng dương: vi rút Rubella bất hoạt.
b) Đánh giá từ bên ngoàiTham gia đánh giá từ bên ngoài (ngoại kiểm, liên phòng hoặc phòng xét nghiệm tham chiếu) và thực hiện hành động khắc phục khi kết quả không đạt.
III. Phương pháp xét nghiệm:
-
Xét nghiệm huyết thanh học phát hiện kháng thể IgM đặc hiệu vi rút Rubella bằng kỹ thuật ELISA.
1.1. Phạm vi áp dụng:
Quy trình xét nghiệm này được áp dụng cho việc chẩn đoán xác định kháng thể IgM kháng vi rút Rubella trong mẫu bệnh phẩm lâm sàng.
1.2. Nguyên lý:
Giếng ELISA được gắn sẵn kháng nguyên vi rút Rubella. Nếu huyết thanh bệnh nhân có kháng thể IgM kháng vi rút Rubella thì sẽ tạo phức hợp miễn dịch kháng nguyên – kháng thể. Cộng hợp gồm kháng IgM của người gắn enzym peroxidase sẽ kết hợp với kháng thể IgM đặc hiệu. Thành phần enzym trong cộng hợp làm xúc tác cho cơ chất chuyển sang màu xanh. Khi dung dịch dừng phản ứng được thêm vào, phản ứng dừng lại và dung dịch sẽ chuyển sang màu vàng.
1.3. Thực hiện xét nghiệm
a/ Loại mẫu– Loại bệnh phẩm: huyết thanh
– Thể tích bệnh phẩm dùng trong xét nghiệm: 10-50 µl
– Điều kiện bảo quản: 4oC (không quá 7 ngày), -20oC đến -70oC (trên 7 ngày).
– Huyết thanh lấy ở tủ âm phải để tan băng ở nhiệt độ phòng trước khi sử dụng
– Pha loãng mẫu huyết thanh theo tỉ lệ 1 + 20: 10 µl mẫu huyết thanh + 200 µl dung dịch pha loãng DILUENT.
– Thêm 210 µl dung dịch hấp phụ RF ABSORBENT vào mẫu huyết thanh đã pha loãng 1+20. Trộn đều và ủ ở nhiệt độ phòng 15 phút hoặc ở 2oC – 8oC qua đêm.
b/ Các bước tiến hành
– Bước 1: Lấy số giếng cần làm, thiết lập sơ đồ giếng cho chứng âm (P/N), 02 chứng dương (P/P1 và P/P2) và mẫu xét nghiệm tra vào ô trắng theo bảng bên dưới, mỗi mẫu cần tra 2 ô song song:

– Bước 2: Cho 150 µl mẫu chứng âm (P/N), mẫu chứng dương (P/P) và mẫu huyết thanh theo sơ đồ đã chuẩn bị.
– Bước 3: Đậy kín phiến nhựa và ủ ở 37 ± 1oC trong 60 ± 2 phút
– Bước 4: Rửa phiến nhựa 4 lần với dung dịch rửa đã pha loãng.
– Bước 5: Cho cộng hợp 100 µl dung dịch cộng hợp đã pha loãng vào mỗi giếng.
– Bước 6: Đậy kín phiến nhựa và ủ ở 37 ± 1oC trong 60 ± 2 phút.
– Bước 7: Rửa phiến nhựa như bước 4.
– Bước 8: Cho 100 µl cơ chất đã pha loãng vào mỗi giếng.
– Bước 9: Đậy kín phiến nhựa.Ủ ở nhiệt độ phòng trong bóng tối/30 ± 2 phút.
– Bước 10: Thêm 100 µl/giếng dung dịch dừng phản ứng vào mỗi giếng.
– Bước 11: Đọc kết quả bằng máy đọc ELISA ở bước sóng kép 450/650nm trong vòng 1 giờ.
c/ Phiên giải kết quả xét nghiệm
Đọc kết quả xét nghiệm:
– Giá trị OD của các mẫu chứng cần phải đạt yêu cầu quy định như sau
– Giá trị chứng âm P/N: < 0.1
– Giá trị chứng dương P/P: ≥ 0.2
– Nếu kết quả các mẫu chứng không thỏa những điều kiện trên phải làm lại phản ứng
– Mỗi loạt sinh phẩm đều có 1 giá trị ngưỡng trên và ngưỡng dưới của chứng dương và được ghi rõ trong bảng các thông số kèm theo từng bộ sinh phẩm:
+ Ngưỡng dưới ≤ ΔOD P/P1; ΔA=OD P/P2 ≤ Ngưỡng trên
(lower margin) (upper margin)
+ ΔOD P/P trung bình – 20% ≤ ΔOD P/P1 ; ΔOD P/P2≤ ΔOD P/P trung bình + 20%

Nhận định kết quả
– Mẫu âm tính khi ΔA < 0,1
– Mẫu dương tính khi ΔA > 0,2
– Mẫu nghi ngờ khi 0,1≤ ΔA ≤0,2
-
Phương pháp xét nghiệm RT-PCR phát hiện ARN của vi rút Rubella
2.1. Phạm vi áp dụng
Quy trình xét nghiệm này được áp dụng cho việc xác định ARN của vi rút Rubella trong mẫu bệnh phẩm lâm sàng.
2.2. Thực hiện xét nghiệm
a/ Mẫu bệnh phẩm
– Mẫu bệnh phẩm để ở nhiệt độ phòng khoảng 30 phút để tan băng (nếu để ở -80oC), trộn kỹ bằng máy vortex
– Tách chiết ARN tổng số theo hướng dẫn của bộ QIAamp Viral RNA mini Kits (tham khảo Mục 4.1.3, Phần III, Hướng dẫn xét nghiệm bệnh cúm).
2.4.3. Các bước tiến hành thực hiện phản ứng RT-PCR
– Cho 3 µl mẫu ARN bệnh phẩm vào hỗn hợp sinh phẩm đã chuẩn bị cho phản ứng RT-PCR.
– Cho các mẫu chứng vào tuýp tương ứng. Mẫu chứng dương: được thực hiện tại tủ An toàn sinh học cấp II.
– Khởi động và kiểm tra chương trình trước khi chạy máy luân nhiệt cổ điển theo yêu cầu xét nghiệm.
– Đặt các tuýp vào máy PCR và cài đặt thiết bị cho phản ứng RT-PCR.
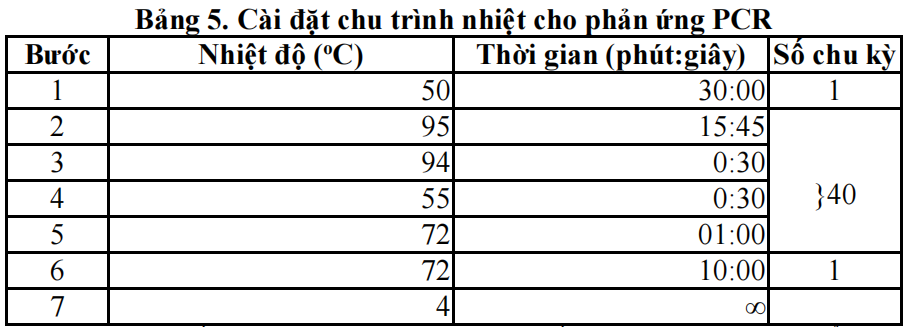
Sau khi kết thúc quá trình luân nhiệt, tiến hành điện di sản phẩm và phân tích kết quả trên bản gel agarose và đọc trên máy chụp UV.
2.4.4. Điện di sản phẩm RT-PCR
Chạy điện di
– Chuyển sản phẩm PCR vào thạch.
– Đặt thạch vào bể điện di theo đúng chiều dòng điện từ âm sang dương rồi cho TBE 1X ngập bản thạch sao cho dung dich đệm cách mặt thạch từ 1 – 2 mm.
– Cho 2 l đệm đặt mẫu (Loading Dye) vào từng giếng của đĩa microtitre hoặc trên giấy parafilm với số lượng tương ứng với số mẫu cần phân tích.
– Trộn 8 µl – 10 µl mỗi sản phẩm PCR với 2 µl đệm đặt mẫu.
– Trộn 5 µl – 8 µl thang chuẩn ADN 100 bp hoặc 1.000 bp với 2 µl đệm đặt mẫu (nếu thang chuẩn AND chưa có sẵn đệm đặt mẫu).
– Chuyển dung dịch đã được trộn với nhau vào trong các giếng của bản thạch.
– Đóng nắp của bể điện di, chọn dòng điện 110V và thời gian 30 phút.
– Tắt máy điện di, chuyển thạch sang máy đọc.
– Soi và chụp ảnh.
– Đặt bản thạch ngay ngắn trên máy đọc gel, bật đèn tím để đọc gel và chụp ảnh.
Chú ý: Do sản phẩm PCR nhạy với đèn tím nên hạn chế để bản thạch tiếp xúc với đèn tím. Ngay sau khi căn chỉnh và chụp được kết quả đẹp cần
tắt ngay đèn tím.
2.5. Phiên giải kết quả xét nghiệm
2.5.1. Đọc kết quả xét nghiệm
– Chứng âm phản ứng: (NTC) nước cất không chứa nuclease (trong bộ sinh phẩm QIAGEN One step RT-PCR Kits) để kiểm tra ngoại nhiễm trong
quá trình pha master mix, phải cho kết quả âm tính.
– Chứng âm tách chiết (NEC): mẫu tách chiết là môi trường vận chuyển và được tách chiết cùng mẫu bệnh phẩm: phải cho kết quả âm tính.
– Chứng dương virus Rubella: có dạng đặc hiệu tương đương với kích thước của cặp mồi là 185bp.
– Nếu kết quả các mẫu chứng không thỏa những điều kiện trên phải làm lại phản ứng.
2.5.2. Nhận định kết quả
a) Kết quả được chấp nhận khi:
– Chứng dương: có băng đặc hiệu tương đương với kích thước của cặp mồi thiết kế (185 bp)
– Chứng âm phản ứng (NTC), chứng âm tách chiết (NEC): âm tính.
– Mẫu âm tính: sự xuất hiện sản phẩm PCR ở các vị trí không đặc hiệu hoặc không có sự hiện diện của sản phẩm PCR.
– Dương tính: sản phẩm PCR đặc hiệu có kích thước bằng kích thước chứng dương.
b) Làm lại xét nghiệm khi có các trường hợp sau xảy ra
– Chứng dương không có vạch đặc hiệu ở vị trí 185 bp: kiểm tra lại chứng dương và thực hiện lại phản ứng ở bước pha hỗn hợp master mix.
– Chứng âm master mix có vạch ở vị trí 185 bp: thực hiện lại phản ứng ở bước pha hỗn hợp master mix.
Tài liệu tham khảo:
” Sổ tay xét nghiệm bệnh truyền nhiễm tập 1″ – Bộ y tế






